カルボン酸は、医薬品から農薬に至る幅広い化合物に遍在するモチーフです。そのため、この汎用性の高い化合物を誘導体化することは、分子の複雑性を高め新たな機能を創出する上で有望な手法としてその開発が求められていました。古典的な変換には、エノラート中間体を介したカルボン酸の α位の官能基化が含まれます。それに比べ、より遠隔位の β位での官能基化は、あまり発展していません。α位および β位官能基化のどちらの場合でも、カルボン酸特有の酸性ヒドロキシプロトンの存在が問題となって所望のエノラートの生成が阻害されてしまいます。そのため、エステルまたはアミドへと変換することで酸性プロトンを「保護」する方法が一般的でした。このような「保護」をすることなくカルボン酸を直接的に官能基化する手法の開発は、多段階の官能基変換を回避し、所望の分子を迅速に合成できるため重要です。
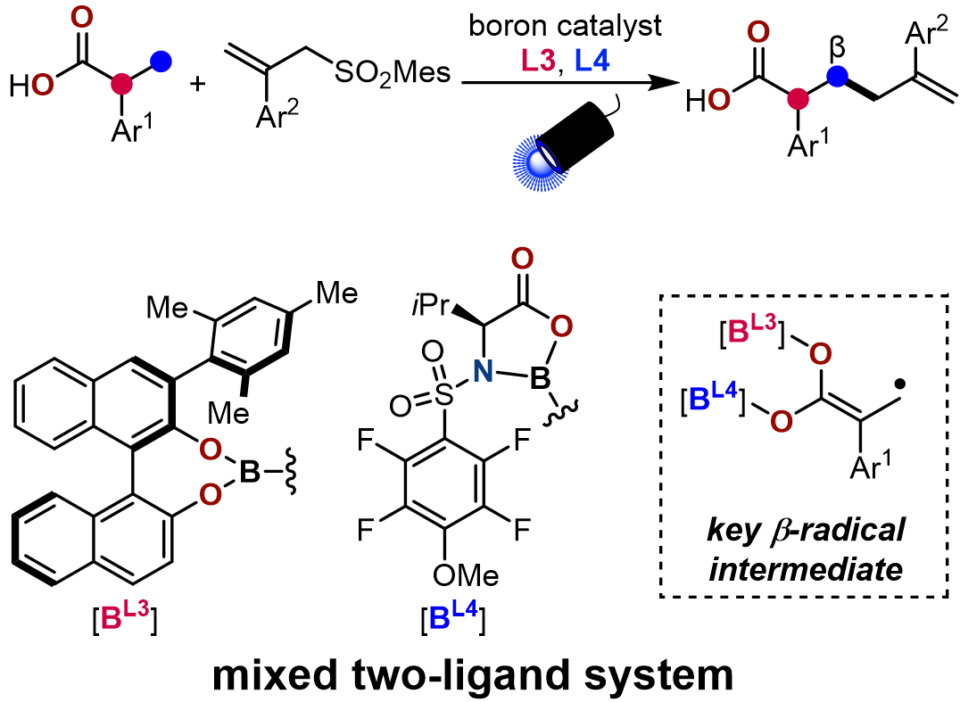
以前、澤村グループは、ホウ素触媒によるカルボン酸の直接 α-アリル化を報告しました。ビピレノール配位子を用いたジボロンエンジオレートの光励起によってアリルスルホンとの電子移動が進行し、生じた二つのラジカル同士のカップリングによって α-アリル化生成物が得られました。研究グループは、ジボロンエンジオレートから中間体として生じるラジカルカチオンのさらなる脱プロトン化によって、ラジカルが α位から β位に転位し、β-アリル化へと反応位置を変えることができると考えました。この研究では、BINOL型配位子とアミノ酸から誘導された配位子を用いる二種配位子混合系によって、目標とした β-アリル化を達成しました。生物活性分子を含む広範なカルボン酸を基質として用いることができ、いずれも優れた選択性で β-アリル化が進行しました。さらに、生成物にもカルボキシ基が残ることを利用して、β-アリル化体をさらに誘導体化することも可能で、これによって分子の複雑性を一挙に増大することもできました。反応機構解析では、触媒サイクルにおいて β-脱プロトン化が重要な役割を果たしていることが明らかとなりました。また、理論計算から、二種配位子混合系は電子的に β-脱プロトン化を促進することに加えて、競合する α-アリル化を立体的に阻害することで、β-アリル化を促進することが示唆されました。この方法論は、新規カルボン酸化合物への道を開くだけでなく、協奏的触媒反応における新しい概念の導入としても期待されます。